LMF: Embriologia (1/2) fecundação -> 2ªsemana
- ReMed

- 19 de jan. de 2021
- 13 min de leitura
1ano 1 semestre
FECUNDAÇÃO
A primeira etapa do desenvolvimento é a formação de um novo indivíduo originário da fusão de um gameta masculino haploide, o espermatozoide, com um gameta feminino também haploide, o ovócito, restaurando assim a diploidia na espécie humana. Desta maneira, fica assegurada a perenidade da espécie com descendentes diferentes de seus pais, mas portadores da mesma quantidade de material genético.
A fecundação é um processo fundamental nos organismos que possuem reprodução sexuada. Existe uma complexa inter-relação entre ambos os gametas. A presença do ovócito é fundamental na aquisição, antes da fertilização, de propriedades funcionais por parte do espermatozoide. Mesmo assim, este é imprescindível para a ativação do metabolismo celular do ovócito, o qual será encarregado de conduzir o desenvolvimento durante os primeiros momentos após a fecundação. Como resultado da fecundação, dois padrões serão definidos em princípio: o complemento cromossômico diploide (2n) e o sexo cromossômico (XX, fêmea, e XY, macho).
PREPARAÇÃO DOS OVÓCITOS PARA A FECUNDAÇÃO
Durante a ovulação, ovócitos mamíferos são liberados do ovário para dentro da cavidade peritoneal próximo a entrada do oviduto, para dentro do qual são levados rapidamente. Eles estão cobertos por várias camadas de células foliculares (ou da granulosa) embebidas em uma matriz extracelular rica em hialuronana (ácido hialurônico). Essas células podem ajudar o ovócito a ser recolhido para dentro do oviduto, e elas também podem secretar sinais químicos (quimiotaxia) não identificados que atraem os espermatozoides para o ovócito.
PREPARAÇÃO DOS ESPERMATOZÓIDES PARA A FECUNDAÇÃO
Dois eventos devem ocorrer antes da fecundação:
(1) a maturação dos espermatozoides no epidídimo
(2) a capacitação dos espermatozoides no trato genital feminino.
EVENTOS MOLECULARES DA FECUNDAÇÃO
É uma complexa sequência de eventos moleculares coordenados que se inicia com o contato entre um espermatozoide e um ovócito e termina com a mistura dos cromossomos maternos e paternos, resultando no zigoto, um embrião unicelular. O processo de fecundação leva cerca de 24 horas, e ocorre normalmente na ampola da tuba uterina.

Passagem do espermatozoide pela corona radiata
Ligação do espermatozoide à zona pelúcida
Reação de acrossomo (reação acrossômica)
Penetração através da zona pelúcida
Fusão das membranas plasmáticas
O conteúdo do espermatozoide entra no citoplasma do ovócito
Passagem do espermatozoide pela corona radiata
A dispersão das células foliculares (ou da granulosa) da corona radiata que circunda o ovócito e a zona pelúcida parece resultar principalmente da ação da hialuronidase liberada pelo acrossomo do espermatozoide. As enzimas da mucosa tubárias também parecem auxiliar nesta dispersão, assim como os movimentos da cauda dos espermatozoides são importantes para a sua penetração na corona radiata.
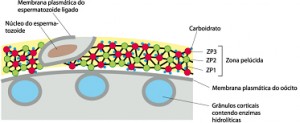
Ligação do espermatozoide à zona pelúcida
Durante a ligação com o espermatozoide, O-oligossacarídeos ligados à ZP3 interagem com os receptores de espermatozoides parecendo serem responsáveis, pelo menos em parte, pela ligação espécie-específica do espermatozoide à zona pelúcida. Entretanto, a ligação do espermatozoide à zona pelúcida é complexa e envolve tanto mecanismos dependentes quanto independentes de ZP3, assim como uma variedade de proteínas da superfície do espermatozoide. A zona pelúcida induz o espermatozoide a sofrer a reação do acrossomo ou reação acrossômica.


Reação do acrossomo ou reação acrossômica
A reação acrossômica é mediada por um aumento na concentração de íons Ca2+ no interior do espermatozoide, através da abertura de canais de Ca2+ na sua superfície. Esse fluxo de Ca2+ é acompanhado por um ingresso de Na+ e pela saída de H+, o que gera um aumento do pH intracelular do gameta. Esta abertura dos canais seria facilitada por uma alteração no potencial de membrana produzido durante o processo de capacitação. A soma destes fatores leva a fusão da membrana acrossômica externa com a membrana plasmática do espermatozoide, formando-se vesículas e poros, e possibilitando a liberação de enzimas para facilitar a passagem deste gameta pela zona pelúcida. Finalizada a reação, a membrana acrossômica interna passa a constituir a membrana externa da cabeça do espermatozoide, em continuidade com o resto de sua membrana plasmática. A primeira, então, é a que entra em contato com a zona pelúcida. Durante essa reação, são liberadas inúmeras enzimas, no entanto, a acrosina, que se encontra unida à membrana acrossômica interna, seria a mais importante na construção do caminho do espermatozoide através da zona pelúcida. Alguns autores sustentam que a acrosina não seria liberada ao meio e, sim, manter-se-ia unida à membrana acrossômica interna durante todo o trajeto.
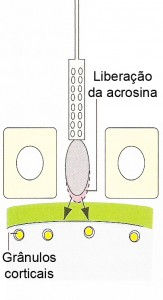
Penetração através da zona pelúcida
Somente os espermatozoides que sofrerem a reação acrossômica é que podem penetrar na zona pelúcida. O primeiro espermatozoide a chegar na zona pelúcida se liga à ZP3, um dos três componentes glicoproteicos. A ligação à ZP3 induz a liberação da acrosina pela membrana acrossômica interna, facilitando a penetração da cabeça do espermatozoide na zona pelúcida.
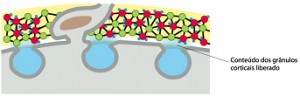
O primeiro espermatozoide a penetrar na zona pelúcida se funde com a membrana do ovócito e induz a exocitose Ca2+ -dependente dos grânulos corticais localizados logo abaixo da membrana plasmática, em

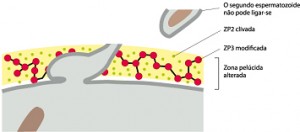
um processo chamado de reação cortical. O conteúdo liberado dos grânulos corticais inativa a ZP3, de modo que ela não pode mais ligar-se a membrana do espermatozoide. Há também a clivagem da ZP2, endurecendo a zona pelúcida de maneira que os espermatozoides não podem penetrá-la. Juntas, estas alterações promovem a reação da zona resultando em um bloqueio à polispermia.
Fusão das membranas plasmáticas do espermatozoide com a do ovócito secundário

Após a passagem pela zona pelúcida, o espermatozoide liga-se à membrana plasmática do ovócito, inclinando-se sobre as microvilosidades na superfície do gameta feminino. Rapidamente as microvilosidades vizinhas se agrupam em torno do espermatozoide para assegurar que este seja aderido de forma firme. Os mecanismos moleculares responsáveis pela fusão entre as membranas dos dois gametas são em grande parte desconhecidos, embora, após um número de ativações artificiais, duas proteínas de membrana têm sido apontadas como fundamentais para a fusão. Uma é a proteína transmembrana da superfamília das imunoglobulinas específica do espermatozoide chamada de Izumo, que torna-se exposta durante a reação acrossômica. A única proteína na superfície do ovócito que se demonstrou necessária foi a proteína CD9, que é um membro da família das tetraspaninas, assim chamadas pois possuem quatro segmentos que transpõem a membrana. Na presença do complexo CD9-integrina e da fertilina α/β, as membranas plasmáticas do espermatozoide e do ovócito se fundem através de mecanismos de adesão intercelular.

Fusão da membranas plasmáticas – ativação do ovócito secundário
Quando o espermatozoide funde-se com a membrana plasmática de um ovócito de uma maneira normal, isso causa um aumento local de Ca2+ citosólico, que se difunde como uma onda através da célula. A onde se propaga por feedback positivo: a elevação do Ca2+ citosólico causa a abertura dos canais de Ca2+, permitindo que ainda mais Ca2+ entre no citosol. A onda inicial da liberação de Ca2+ normalmente é seguida, dentro de poucos minutos, por oscilações de Ca2+ que persistem por várias horas. O espermatozoide que realizou a fusão dispara a onda e as oscilações de Ca2+ por introduzir um fator dentro do citosol do ovócito, que causa um aumento na concentração de inositol 1,4,5-trifosfato (IP3), o qual libera Ca2+ do retículo endoplasmático e inicia a onda e as oscilações de Ca2+. Um candidato forte para ser este fator critico é uma fosfolipase C específica de espermatozoides, a PLC ζ que cliva diretamente o fosfoinositol 4,5-bifosfato (PI[4,5]P2) para produzir IP3 e diacilglicerol.
O ovócito termina sua segunda divisão meiótica imediatamente após a penetração do espermatozoide, formando um ovócito maduro e um segundo corpo polar. Os cromossomos maternos se descondensam e o núcleo do ovócito maduro torna-se o pronúcleo feminino.
O conteúdo do espermatozóide entra no citoplasma do ovócito
A cabeça e a cauda do espermatozoide entram no citoplasma do ovócito, mas a membrana plasmática e as mitocôndrias ficam para trás, e a cauda degenera. Dentro do citoplasma do ovócito, o núcleo do espermatozoide aumenta para formar o pronúcleo masculino. Morfologicamente, os dois pronúcleos são indistinguíveis. Durante o crescimento dos pronúcleos, eles replicam o seu DNA-1n (haploide), 2c (duas cromátides). O ovócito contendo dois pronúcleos haploides é chamado de oótide. Os pronúcleos se aproximam e seus envelopes nucleares formam interdigitações. Um centrossomo se forma em torno dos centríolos fornecidos pelo espermatozoide, uma vez que em ovócitos não fecundados, estas estruturas não estão presentes. O centrossomo se duplica, os envelopes nucleares se rompem, e finalmente, os cromossomos dos gametas são integrados em um fuso mitótico único, que organiza a primeira divisão mitótica da clivagem. Logo que os pronúcleos se fundem em uma agregação de cromossomos única e diploide, a oótide torna-se um zigoto.

Zigoto
O zigoto é geneticamente único porque metade dos seus cromossomos vem da mãe e a outra metade vem do pai. O zigoto contém uma nova combinação de cromossomos que é diferente da contida nas células dos pais. Esse mecanismo forma a base da herança biparental e da variação da espécie humana. A meiose possibilita a distribuição independente dos cromossomos paternos e maternos entre as células germinativas. O crossing over dos cromossomos, por relocação dos segmentos dos cromossomos paternos e maternos, “embaralha” os genes, produzindo assim uma recombinação do material genético. O sexo cromossômico do embrião é determinado na fecundação pelo tipo de espermatozoide, X ou Y, que fecunda o ovócito. A

fecundação por um espermatozoide portando um X produz um zigoto 46, XX, que se desenvolve fêmea, enquanto a fecundação por um espermatozoide portando um Y produz um zigoto 46, XY, que se desenvolve macho.
O zigoto é a uma célula totipotente por excelência, porque é capaz de gerar todos os tipos celulares do organismo. Embora não seja tecnicamente uma célula-tronco, porque não é capaz de autorenovação, o zigoto dá origem a células com propriedades de célula-tronco. Por exemplo, o embrião de camundongo, passa pelo estádio de oito células no qual cada célula pode dar origem a qualquer tipo celular do embrião. Se as oito células forem separadas experimentalmente e implantadas individualmente em uma fêmea receptora apropriada, cada uma pode formar um camundongo completo. Esse experimento mostra que as oito células são capazes de formar todos os tecidos, ou seja, elas são células totipotentes. Desse modo, a subdivisão do organismo em partes e tecidos entre as células embrionárias iniciais não é irreversível quando ocorre no estádio de oito células. No estádio de 16 células, isso não é mais verdadeiro; algumas células estão comprometidas com vias de diferenciação particulares.
1ª semana do desenvolvimento – Nidação
O blastocisto fica por cerca de dois dias flutuando no útero, enquanto ocorre a degeneração total da zona pelúcida, e enquanto isto, se nutre das secreções das glândulas uterinas. Aproximadamente após 6 dias da fecundação, o blastocisto inicia a implantação no epitélio endometrial, evento este conhecido também por nidação (Fig.4 – A). A nidação se inicia pelo pólo embrionário, região onde fica o embrioblasto (massa celular interna), e o trofoblasto logo se diferencia em duas camadas (Fig.4 – B):
Citotrofoblasto: camada interna de células.
Sincíciotrofobasto: massa celular multinucleada em rápida expansão, na qual nenhum limite celular pode ser observado.
O sincíciotrofoblasto produz enzimas que erodem os tecidos maternos, possibilitando ao blastocisto se implantar dentro do endométrio, sendo altamente invasivo e se expandindo rapidamente. Em torno de 6 dias, os prolongamentos digitiformes do sincíciotrofoblasto se estendem para o epitélio endometrial e invadem o tecido conjuntivo (Fig.4 – B). O epitélio superficial da mucosa uterina “aprisiona” o blastocisto em um meio extracelular que contém receptores para colágeno, laminina, fibronectina, ácido hialurônico e heparan sulfato. As células do trofoblasto possuem integrinas que se unirão ao colágeno do útero, fibronectina, laminina e proteoglicanos de heparan sulfato. Uma vez aderido, o trofoblasto produz outras proteínas, como colagenase, estromelisina e ativador de plasminogênio. Suas enzimas digerem a matriz extracelular do endométrio, permitindo que o blastocisto penetre nele. Além da ação enzimática do embrião, é importante o comportamento do próprio endométrio. A diminuição do pH parece produzir perda de adesividade entre as células endometriais, o que facilita a nidação. Também é importante a liberação de histamina, com consequentes vasodilatação e edema. O sincicitrofoblasto é o responsável pela produção do hormônio HCG, que mantém a atividade hormonal do corpo lúteo e é o principal hormônio dos testes de gravidez.
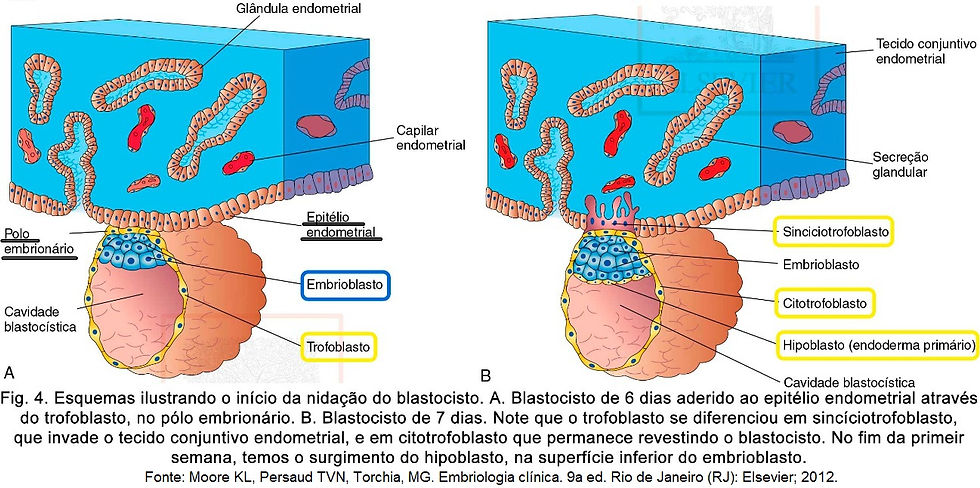
No fim da primeira semana, o blastocisto encontra-se parcialmente implantado e obtém sua nutrição a partir dos tecidos maternos erodidos. Em torno de 7 dias, uma camada de células, o hipoblasto (endoderma primitivo), surge na superfície do embrioblasto voltada para a cavidade blastocística. Dados embriológicos comparativos sugerem que o hipoblasto surge por delaminação dos blastômeros do embrioblasto.
1ª semana do desenvolvimento – Clivagem e formação do blastocisto
Processo natural que ocorre cerca de 30 horas após a fecundação quando o zigoto atravessa a tuba uterina em direção ao útero. São repetidas divisões mitóticas do zigoto, que ocorrem com autoduplicação de DNA entre uma e outra, resultando em um rápido aumento no número de células. A localização dos centríolos em cada célula determinaria a posição do fuso mitótico, e com ele a progressão dos microtúbulos encarregados de marcar a orientação dos planos de clivagem no espaço. A zona cortical do zigoto possui um citoesqueleto com microfilamentos abundantes de actina, formando complexos com a miosina. A capacidade contrátil que estas estruturas conferem ao córtex vincula-se ao início da citocinese, para obter a formação do primeiro sulco de segmentação e, provavelmente, também, para as sucessivas clivagens (Fig.1 – A). Existem evidências experimentais que nos fazem supor que as membranas plasmáticas divisórias formadas entre os blastômeros surgem por diferentes mecanismos, tais como isolamento de irregularidades na superfície do ovócito, fusão de vesículas citoplasmáticas com a membrana plasmática e neogênese de membranas que responde a outros mecanismos. As células embrionárias resultantes dessa divisão são chamadas de blastômeros, que tornam-se menores a cada divisão, pois não há efetivamente síntese de componentes citoplasmáticos entre uma divisão e outra, de maneira que a massa citoplasmática original se divida proporcionalmente entre as novas células-filhas (Fig.1 – B, C, D e E, e Fig.2). Os blastômeros são, a princípio, totipotentes. Depois, quando é fixado o destino de uma célula, diz-se que a mesma está determinada. Ao contrário, a diferenciação refere-se ao processo de especialização fenotípica de uma célula. As células embrionárias do mesmo tipo aderem-se entre si, segundo bases moleculares de agregação celular, regidas por moléculas de adesão (CAMs) presentes em sua superfície, que podem ou não ser dependentes de cálcio. Durante toda a clivagem, o zigoto se encontra envolto pela zona pelúcida, permitindo o aumento no número de células, sem aumentar o tamanho total do zigoto.

Após o estágio de nove células, os blastômeros mudam sua forma e se agrupam firmemente uns com os outros para formar uma massa compacta de células em um fenômeno chamado de compactação, que provavelmente é mediado por glicoproteínas de adesão de superfície celular. A compactação inclui também o desenvolvimento de especializações de membranas, que contribuem para a coesão e comunicação entre as células. Entre os blastômeros periféricos existem zonas de oclusão e desmossomas, enquanto mais profundamente aparecem nexos de comunicação intercelular (junções comunicantes ou do tipo “gap”). As junções de oclusão (tight junctions) separam o meio externo, que circunda o embrião, do meio interno, cujas características dependem unicamente das células embrionárias. Evita-se assim a difusão livre de substâncias no nível do compartimento intercelular. Isto é fundamental para que se desenvolvam diferenças na potencialidade evolutiva dos blastômeros. Essa compactação possibilita uma maior interação célula-célula e é um pré-requisito para a segregação das células internas que formam a massa celular interna ou embrioblasto no estágio de blastocisto (Fig.3 – B e C). Quando o zigoto alcança 12 a 32 blastômeros, passa a ser denominado de Mórula (aspecto de amora), quando, então, alcança o útero (Fig.1 – E e Fig.3 – A).
Assim que a mórula alcança a cavidade uterina, a zona pelúcida entra em degeneração, fato este que permitirá a passagem de líquido da cavidade uterina, formando um espaço cheio de fluido entre os blastômeros. Este espaço será denominado de cavidade blastocística ou blastocele (Fig.3- B). A degeneração da zona pelúcida também permite ao blastocisto aumentar rapidamente de tamanho.
Conforme a cavidade blastocística aumenta, os blastômeros se separam em duas partes:
Trofobasto: camada delgada de células externas que irá compor a parte embrionária da placenta.
Embrioblasto: grupo de blastômeros localizados centralmente, também chamado de massa celular interna, que dará origem ao embrião.
Nesse estágio do desenvolvimento conhecido como blastogênese, o concepto é conhecido como blastocisto, e é este blastocisto que vai aderir ao epitélio endometrial por ações de enzimas proteolíticas (metaloproteinases) (Fig 3 – C).

2ª semana do desenvolvimento embrionário

As modificações morfológicas observadas na segunda semana do desenvolvimento ocorrem durante a implantação do embrião no endométrio, pela rápida expansão do sincíciotrofoblasto, estando completamente implantado no final desta semana. Contudo, os embriões resultantes de fertilizações ocorridas na mesma época não mostram necessariamente a mesma velocidade de desenvolvimento. De fato, diferenças consideráveis na velocidade de crescimento têm sido encontradas mesmo nos estágios iniciais do desenvolvimento.
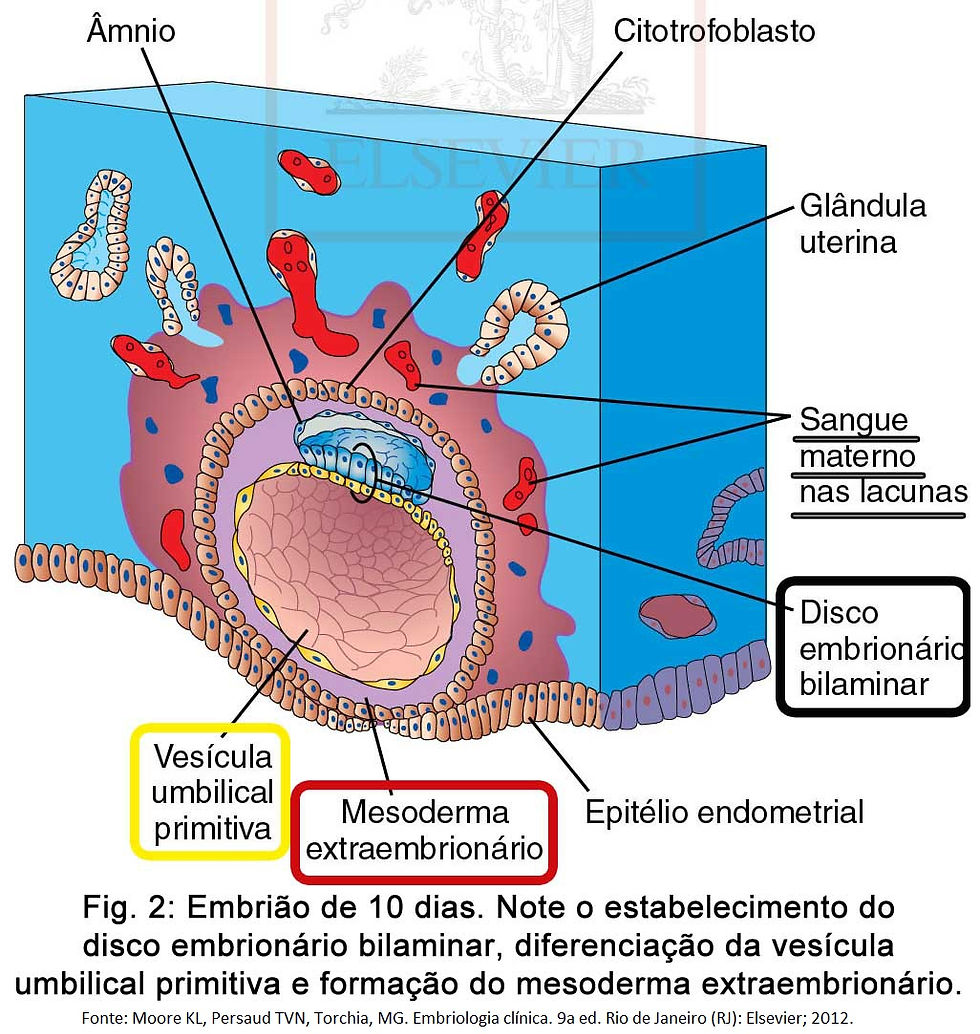
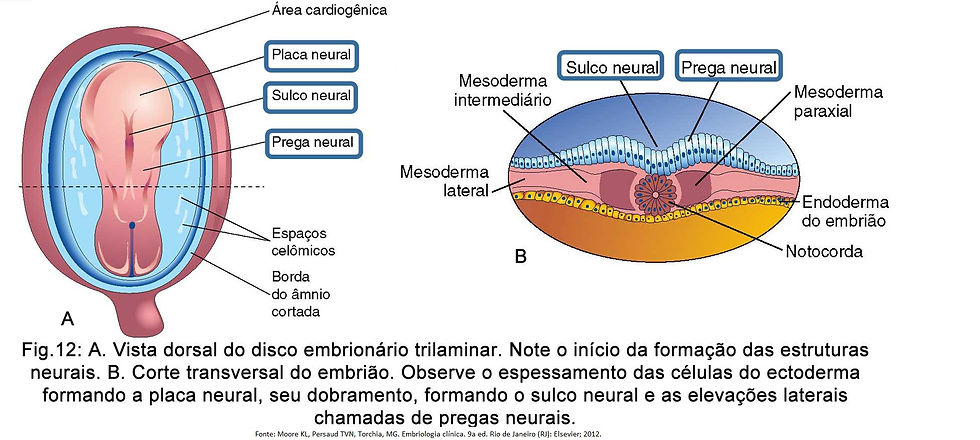
Com a progressão da implantação do blastocisto, surge um pequeno espaço no interior do embrioblasto (Fig. 1-A), que dará origem à cavidade amniótica revestida pelo âmnio (originado dos amnioblastos) (Fig. 1-B).
Concomitantemente, o embrioblasto sofre alterações morfológicas até se tornar um disco embrionário bilaminar, que origina as camadas germinativas responsáveis pela formação dos órgãos e tecidos do embrião, formado por (Fig. 1-B):
epiblasto: camada mais espessa, constituído por células cilíndricas altas, forma o assoalho da cavidade amniótica e está em continuidade com o âmnio.
hipoblasto: constituído por células pequenas cuboides, forma o teto da cavidade exocelômica e está em continuidade com a membrana exocelômica.
Enquanto isso, células achatadas, provavelmente provenientes do hipoblasto, se diferenciam e migram para a superfície interna do citotrofoblasto dando origem à membrana exocelômica, resultando na formação da cavidade exocelômica, (Fig. 1-B) que sofrerá uma rápida modificação em vesícula umbilical primitiva (saco vitelino primitivo em alguns livros) (Fig. 2).

O disco embrionário agora se encontra entre a cavidade amniótica e a vesícula umbilical primitiva. Após a formação do âmnio, do disco embrionário e da vesícula umbilical primitiva, surgem as lacunas, cavidades isoladas no sincíciotrofoblasto, que ao se comunicarem com capilares endometriais rompidos estabelecem a circulação uteroplacentária primitiva.
Nesse meio tempo, uma nova população de células aparece entre a superfície interna do citotrofoblasto e a superfície externa da cavidade exocelômica. Essas células, derivadas das células da vesícula umbilical, formam um tecido conjuntivo frouxo e delgado, o mesoderma extraembrionário, que circunda o âmnio e a vesícula umbilical (Fig. 2).
À medida que o trofoblasto e o endométrio sofrem mudanças, o mesoderma extraembrionário cresce e nele surgem espaços isolados (Fig. 3-A) que se fundem e formam uma grande cavidade denominada celoma extraembrionário (Fig. 3-B). É uma cavidade preenchida por fluido e envolve o âmnio e a vesícula umbilical, com exceção da área aderida ao citotrofoblasto pelo pedículo de conexão (pedículo do embrião em edições anteriores de livros) (Fig. 4-A). Este pedículo de conexão participará da formação do cordão umbilical. Com a formação do mesoderma extraembrionário, a vesícula umbilical primitiva diminui de tamanho com o deslocamento de parte de sua parede, diferenciando-se em vesícula umbilical secundária (saco vitelino definitivo) (Fig. 4 – A).
O termo vesícula umbilical é preferível porque o vitelo não está presente na vesícula humana, sendo denominada de vesícula umbilical. Entretanto, ela exerce importantes funções, tendo provavelmente papel importante na transferência seletiva de nutrientes para o embrião.
Com a formação do celoma extraembrionário, o mesoderma extraembrionário é dividido em duas camadas: (Fig. 3-B)
mesoderma somático extraembrionário: reveste o trofoblasto, cobre o âmnio e ao associar-se com as duas camadas de trofoblasto forma o córion.
mesoderma esplâncnico extraembrionário: envolve a vesícula umbilical.
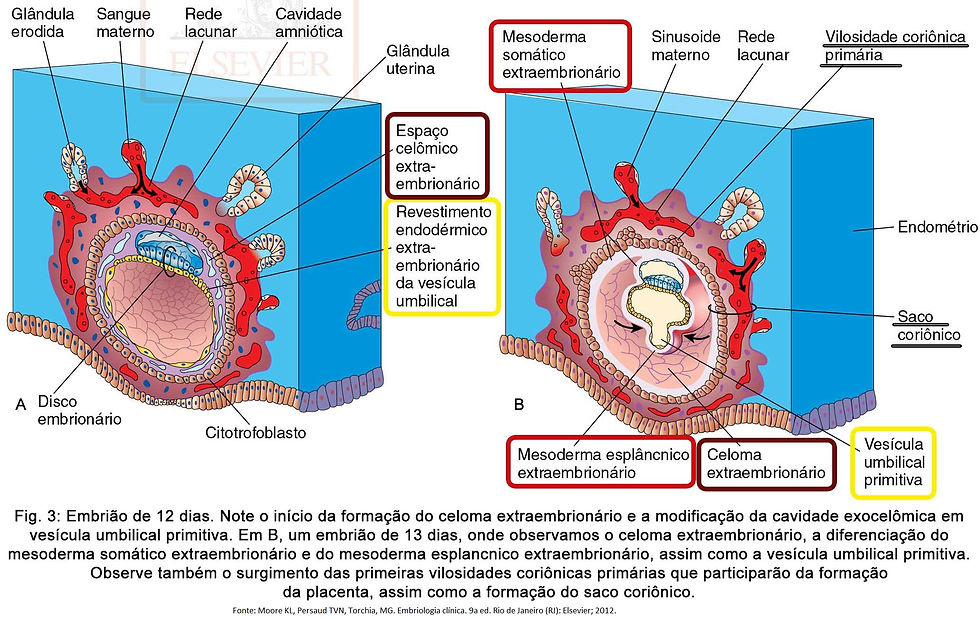
O mesoderma somático extraembrionário e as duas camadas de trofoblasto, o citotrofoblasto e o sincíciotrofoblasto, formam o córion. O córion forma a parede do saco coriônico, dentro do qual o embrião, a cavidade amniótica e a vesícula umbilical estão suspensos pelo pedículo de conexão. O celoma extraembrionário é agora chamado de cavidade coriônica. (Fig. 3-B)
O crescimento do disco embrionário bilaminar é relativamente lento comparado ao do citotrofoblasto; consequentemente, o disco permanece muito pequeno. Enquanto isso, as células do endométrio tornam-se poliédricas e carregadas de glicogênio e lipídeos; os espaços intracelulares ficam repletos de material extravasado, e o tecido torna-se edematoso. Essas mudanças são conhecidas como reação decidual, que se restringem a principio à área que envolve imediatamente o local de implantação, mas dentro em pouco ocorrem em todo o endométrio. Durante a reação decidual, os leucócitos que infiltraram o seu estroma produzem interleucina-2, que evita o desconhecimento do embrião por parte do organismo materno, que pode chegar a considera-lo um corpo estranho. Os mecanismos imunológicos mediante os quais a mãe aceita o embrião não são, todavia, bem conhecidos. Os abortos espontâneos são, de todas as maneiras, de uma grande frequência (50%); a maioria dos quais ocorre dentro das 3 primeiras semanas de gravidez. Geralmente correspondem a grandes anomalias do embrião.
No fim da segunda semana, surgem as vilosidades coriônicas primárias que são extensões de células do citotrofoblasto que proliferam e crescem para dentro do sincíciotrofoblasto, sendo o primeiro estágio no desenvolvimento das vilosidades coriônicas da placenta. É possível que o mesoderma somático extraembrionário leve ao crescimento dessas extensões. (Fig. 3- B)
No 14º dia, o embrião ainda possui a forma de disco embrionário bilaminar, porém em uma área específica, algumas células hipoblásticas se tornam colunares formando uma área circular espessada – a placa precordal, indicando o futuro local da boca e um importante centro organizador da região da cabeça. (Fig. 4).






Comentários