NCS: metabolismo de proteína, dieta hiperproteica, icterícia, testosterona x corpo feminino
- ReMed

- 10 de jan. de 2021
- 25 min de leitura
1ano 1semestre 3módulo4SP
20 de Maio de 2019




QUESTÕES
Caracterize proteína e explique seu metabolismo (ingestão -> excreção)
Como a mídia pode gerar estereótipos de beleza
Relacione uma dieta hiperproteica com a falha hepática e renal (como a dieta hiperproteica pode levar a falha hepática e renal)?
Conceitue icterícia e relacione com excesso de testosterona pelo uso de anabolizantes
Quais as aplicações do exercício físico no metabolismo proteico?
Explique as ações do excesso de testosterona no corpo feminino
1. CARACTERIZENPROTEÍNA E EXPLIQUE SEU METABOLISMO (INGESTÃO -> EXCREÇÃO) B

As proteínas consistem de um grupo funcional ácido carboxílico (-COOH), um grupo amino (-NH2) e um hidrogênio (-H) ligados ao átomo de carbono-α. Grupos-R (cadeia lateral) distintos, também estão associados ao carbono-alfa, desta forma, o carbono-α encontrado nos aminoácidos é tetraédrico ou assimétrico (exceto no caso da glicina onde o grupo-R é o hidrogênio). Um aminoácido difere de outro justamente pelo grupo-R (cadeia lateral).
São exemplos de suas atividades: a formatação e a organização interna à célula, a fabricação de produtos, a limpeza de resíduos, a manutenção, o recebimento de sinais extracelulares e a mobilização de uma resposta intracelular aos sinais.
As proteínas são macromoléculas de alto peso molecular, polímeros de compostos orgânicos simples, os α-aminoácidos. Nas moléculas proteicas os aminoácidos se ligam covalentemente, formando longas cadeias não ramificadas, através de ligações peptídicas envolvendo o radical amino (-NH2) de um aminoácido e o radical ácido carboxílico (- COOH) de um outro, havendo a liberação de uma molécula de água durante a reação.
A união entre dois aminoácidos, forma um dipeptídeo, assim como três unem-se formando um tripeptídeo e assim sucessivamente, sendo que a união de vários aminoácidos irá dar origem a uma cadeia polipeptídica.
São conhecidos 20 aminoácidos (Alanina, Arginina, Aspartato, Asparagina, Cisteína, Fenilalanina, Glicina, Glutamato, Glutamina, Histidina, Isoleucina, Leucina, Lisina, Metinonina, Prolina, Serina, Tirosina, Treonina, Triptofano e Valina) encontrados nas moléculas de proteínas, com sua síntese controlada por mecanismos genéticos, envolvendo a replicação do DNA e transcrição do RNA.
A metade dos aminoácidos é sintetizada pelo organismo e vai suprir as necessidades celulares; aqueles que não são sintetizados precisam estar presentes na dieta e são chamados de aminoácidos essenciais e os aminoácidos não-essenciais aqueles que são sintetizados no organismo.
OBS.:
Proteínas transportadoras
São aquelas que atuam no transporte de moléculas para dentro e para fora das células. São proteínas da membrana plasmática.
A hemoglobina, por exemplo, é uma proteína transportadora. Presente nas hemácias, transporta o oxigênio dos pulmões para os tecidos do corpo.
Proteínas reguladoras
Existem alguns tipos de hormônios que são proteínas e possuem a função de regular atividades metabólicas no organismo.
Podemos citar como exemplo de proteína reguladora a insulina. Sintetizada no pâncreas, ela atua no metabolismo de lipídeos e proteínas, além de ser responsável pela entrada da glicose nas células.
Proteínas de defesa (anticorpos)
Atuam no sistema imunológico do nosso organismo, ou seja, possuem a função de protegê-lo de organismos estranhos (vírus, bactérias e etc.) que penetram em nosso organismo.
A trombina e o fibrinogênio também são proteínas de defesa, pois atuam na coagulação do sangue em caso de ferimentos e cortes, evitando a perda sanguínea.
Proteínas catalisadoras
Estas proteínas possuem a função de acelerar e facilitar reações químicas que ocorrem no interior das células. As enzimas, por exemplo, são proteínas catalisadoras.
Proteínas estruturais
São aquelas que possuem a função de promover a sustentação estrutural aos tecidos do organismo. Podemos citar como exemplos: elastina (atua na estrutura da pele) e queratina (atua na estrutura dos pelos, unhas e cabelos).
Proteínas contráteis
Estas proteínas possuem a função de possibilitar a contração das fibras dos músculos. A miosina e a actina são exemplos de proteínas contráteis.
O estudo da composição e polaridade do grupamento R permite agrupar os aminoácidos em quatro classes distintas:
a) Aminoácidos com grupamento R apolar ou hidrofóbico:
são os menos solúveis, devido à ausência de grupamentos hidrofílicos no grupamento R.
São eles:
• Cadeia alifática hidrocarbonada: alanina, leucina, isoleucina, valina e prolina;
• Anel aromático: fenilalanina e triptofano;
• Tioéter: metionina.
• Hidrogênio: glicina.
A alanina representa o aminoácido mais solúvel deste grupo e a prolina é, na realidade, um iminoácido onde o grupamento R é um substituinte do aminogrupo.
A glicina é o aminoácido mais simples em virtude de possuir como R apenas um átomo de hidrogênio (apolar), sendo também o único aminoácido que não possui carbono assimétrico. Algumas vezes é classificado como polar, pois o grupamento funcional lhe confere certa solubilidade.
b) Aminoácidos com grupamento R polar não-carregado: possuem grupamentos hidrofílicos na cadeia carbonada que não se ionizam, porém conferem maior solubilidade ao aminoácido. São eles:
• Hidroxila: serina, treonina e tirosina;
• Grupo Amida: asparagina e glutamina;
• Sulfidrila ou Tiol: cisteína;
A cisteína e a tirosina tem os grupamentos R mais polares, sendo portanto os mais solúveis desta classe. A cisteína, frequentemente, ocorre nas proteínas em sua forma oxidada, a cistina, na qual a sulfidrila (- SH) estão unidas formando pontes dissulfeto (S-S) que são ligações covalentes importantes na estabilização da molécula proteica.
A asparagina e a glutamina são amidas do ácido aspártico e do ácido glutâmico, respectivamente.
c) Aminoácidos com grupamento R polar carregado positivamente (básicos):
Lisina, arginina e histidina; todos possuem grupamento R de 6 carbonos e a carga positiva localiza-se em um átomo de nitrogênio do R.
d) Aminoácidos com grupamento R polar carregado negativamente (ácidos):
Ácido aspártico e ácido glutâmico. São citados como aspartato e glutamato em virtude de se ionizarem em pH fisiológico adquirindo carga negativa no grupamento carboxila (- COO-).

Cada tipo de proteína possui uma configuração tridimensional peculiar que é determinada pela sequência de aminoácidos e pelo grau de inclinação entre as ligações químicas (proporcionada pelos arranjos intermoleculares). A estrutura molecular das proteínas é muito complexa, por essa razão é conveniente dividi-la em níveis distintos de organização.
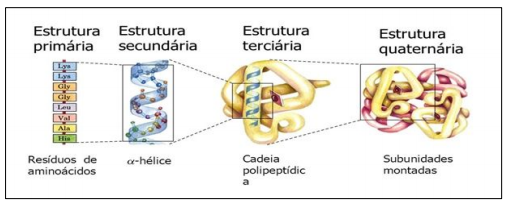

1) Estrutura primária:
diz respeito à sequência de aminoácidos, dada pela sequência de nucleotídeos da molécula de DNA responsável por sua síntese. A estrutura primária de peptídeos e proteínas refere-se ao número linear e a ordem dos aminoácidos presentes. A convenção para a designação da ordem dos aminoácidos é a de que o Nterminal (ou seja, o final com o resíduo com o grupo α-amino livre) é para a esquerda (é do primeiro aminoácido) e do C-terminal (ou seja, o fim com o resíduo que contém um grupo carboxila livre) é para a direita. Nesta estrutura são encontradas ligações peptídicas e eventualmente, dependendo da proteína, podem ser encontradas ainda as pontes de dissulfeto.

Esta sequência deve ser fundamentalmente mantida, sob o peso de a proteína perder sua função, como é o caso da presença de valina ao invés de glutamato no sexto aminoácido da cadeia polipeptídica da hemoglobina, que causa a doença genética denominada de anemia falciforme. A ausência ou acréscimo de aminoácidos à estrutura primária das proteínas, também pode ser responsável por modificação em sua eficácia funcional.
2) Estrutura secundária:

relaciona a forma que a cadeia polipeptídica assume no espaço, que pode ser de α-hélice ou β-folha pregueada. A conformação em α-hélice é conferida através do ângulo de torção que os resíduos de aminoácidos apresentam na ligação peptídica, estabilizada por pontes de hidrogênio entre o oxigênio do grupamento carboxila de um Cα e o H do grupamento amino do outro aminoácido.
A forma de β-folha pregueada é possível graças a pontes de hidrogênio que ocorrem entre duas partes da cadeias polipeptídicas dentro da molécula proteica. Uma proteína pode apresentar os dois tipos de organização secundária dentro de sua molécula proteica, resultante entre pontes de hidrogênio entre elas, resultando em um dobramento entre os aminoácidos sobre si formando um ângulo característico que lembra as folhas pregueadas dos formulários contínuos.
3) Estrutura terciária:

corresponde às relações da cadeia polipeptídica no sentido de estabilizar a conformação tridimensional.
Muitos tipos de interações químicas podem ocorrer dentro de uma molécula proteica para garantir a estabilidade das cadeias polipeptídicas.
As mais fortes são as ligações covalentes, como a que ocorre entre dois aminoácidos cisteína que se unem através de pontes dissulfetos entre seus grupamentos – SH formando o complexo cistina.
OBS.:
Há, ainda a formação de pontes de hidrogênio, interações eletrostáticas e interações fracas de van der Waals entre os grupamentos R.

Forças não covalentes que estabilizam a estrutura proteica tridimensional:
-Pontes de Hidrogênio: Grande número de pontes de H são formadas no interior e na superfície das proteínas. Além de formar pontes de H entre si, os grupos polares das cadeias laterais dos aminoácidos podem interagir com a água ou com o esqueleto polipeptídico. As pontes de H contribuem moderadamente para direcionar o enovelamento.
-Interações Hidrofóbicas: São as forças não covalentes mais importantes para a estabilidade da estrutura enovelada. Ocorrem entre aminoácidos de cadeia lateral hidrofóbica, excluindo e afastando as moléculas de água no momento da ligação.
-Interações eletrostáticas (ligações iônicas): Ocorrem entre aminoácidos que possuem carga positiva ou negativa na cadeia lateral.
-Forças de van der Waals: É uma força de atração inespecífica que ocorre quando dois átomos quaisquer estão próximos. Apesar dessas forças serem comparativamente fracas em relação as demais, o efeito cumulativo de numerosas interações tem substancial influência para a estabilidade da estrutura enovelada.
4) Estrutura quaternária:
é o arranjo espacial entre cadeias peptídicas das proteínas oligoméricas, definida por interações não covalentes entre as cadeias peptídicas e outros compostos de origem não proteica que, frequentemente, fazem parte da proteína.
A estrutura quaternária, portanto diz respeito ao arranjo não covalente formado por várias cadeias polipeptídicas como é o caso da hemoglobina.
A configuração espacial final das proteínas (estrutura terciária ou quaternária) é constante e determinante das funções biológicas por elas exercidas.
As proteínas globulares são esferas compactas e irregulares resultantes do enovelamento da cadeia polipeptídica. São bastante solúveis em água e possuem funções diversificadas. A mioglobina e a hemoglobina são exemplos.
As proteínas fibrosas são proteínas de formato cilíndrico, apresentam baixa solubilidade em água e possuem funções estruturais. (p.ex.: colágeno e queratina). O colágeno é pouco solúvel em água; apresenta uma tripla hélice estabilizada por pontes de hidrogênio. Com uma sequência repetida de glicina, prolina e hidroxiprolina. Possuindo também ligações cruzadas covalentes de alisinas que aumentam a sua resistência tensional. A formação de hidroxiprolina e hidroxilisina requer vitamina C.
Proteínas conjugadas
Muitas proteínas apresentam em sua composição, moléculas não proteicas ligadas de forma covalente ou não aos aminoácidos das proteínas, denominados, genericamente, de grupo prostético.
A hemoglobina é uma proteína conjugada cujo grupamento prostético são quatro grupamentos hemes que se ligam de forma não covalente às cadeias peptídicas.
Um grupo importante de proteínas conjugadas são as glicoproteínas que estão presentes na superfície celular (p.ex.: mucina), fazem parte de proteínas estruturais (p. ex.: o colágeno), são hormônios (p.ex.: glucagon) ou receptores de membrana. A glicose liga-se de maneira irreversível a uma fração da hemoglobina (hemoglobina glicada) e permite a monitoração da concentração de glicose plasmática (glicemia) até 120 dias (vida média da hemoglobina) antes da coleta de sangue. Outra fração de glicose fixa-se à albumina formando as frutosaminas que, à maneira da hemoglobina glicada, monitora a glicemia anterior da coleta em até 30 dias (vida média das albuminas).
As lipoproteínas são importantes transportadoras dos lipídios plasmáticos, principalmente os triglicerídeos e o colesterol.
De acordo com a variação das lipoproteínas pode-se avaliar o risco para doenças cardíacas coronarianas.
(1)
METABOLISMO
--Desnaturação proteica
modificação das propriedades físicas e biológicas das proteínas.
Fatores que provocam desnaturação:
-ácido
-valores extremos de pH
-temperatura.
--Catabolismo das proteínas -> aminoácidos
-“Pool” Metabólico de Aminoácidos
® “Turn over” - constante degradação e síntese de proteínas
® equilíbrio dinâmico devido ao “pool” de aminoácidos que pode ser requisitado a qualquer momento para suprir uma necessidade apropriada.
-Catabolismo de Aminoácidos
®formação de intermediários do Ciclo de Krebs (ác. oxalacético, ác. α-cetoglutárico, fumarato), piruvato, acetil CoA, aceto-acetato
®excreção dos produtos residuais sob forma de uréia, creatinina e ácido úrico.

Os aminoácidos livres estão presentes em todo o organismo, como por exemplo, nas células, no sangue e nos fluidos extracelulares. Para a presente discussão, consideraremos todos esses aminoácidos como pertencendo a uma única entidade, o chamado conjunto dos aminoácidos.
Esse conjunto provém de três fontes:
1) aminoácidos liberados pela hidrólise das proteínas teciduais;
2) aminoácidos derivados de proteínas da dieta;
3) aminoácidos não essenciais sintetizados a partir de intermediários simples do metabolismo
Por sua vez, esse conjunto pode ser desgastado de três formas:
1) síntese de proteínas para o organismo;
2) utilização para síntese de pequenas moléculas nitrogenadas essenciais;
3) conversão dos aminoácidos em glicose, glicogênio, ácidos graxos, corpos cetônicos ou CO.
Embora o conjunto de aminoácidos seja pequeno (contém cerca de 90 a 100 g de aminoácidos) em comparação com a quantidade de proteína corporal (cerca de 12 kg em um homem de 70 kg), ele está, conceitualmente, no centro de todo o metabolismo do nitrogênio no organismo.
------------------Renovação das proteínas
No organismo, a maioria das proteínas é constantemente sintetizada e então degradada, permitindo a remoção de proteínas anormais ou desnecessárias. Para muitas proteínas, a regulação da síntese determina sua concentração na célula, com a degradação proteica apresentando menor importância nessa avaliação. Para outras proteínas, a velocidade de síntese é constitutiva, ou seja, relativamente constante, e os níveis celulares da proteína são controlados por degradação seletiva.

1. Velocidade de renovação. Em adultos saudáveis, a quantidade total de proteína corporal permanece constante, pois a taxa de síntese proteica é suficiente apenas para substituir a proteína degradada. Esse processo, denominado renovação das proteínas, leva à hidrólise e à ressíntese de 300 a 400 g de proteína corporal por dia. A taxa de renovação das proteínas varia amplamente de acordo com o tipo de proteína. As de curta duração (p. ex., muitas pro- teínas reguladoras e proteínas organizadas de forma errônea) são degradadas rapidamente, apresentando meias-vidas de minutos ou horas. As de longa duração, com meias-vidas de dias a semanas, constituem a maioria das proteínas celulares. Proteínas estruturais, como o colágeno, são metabolicamente estáveis e apresentam meias-vidas de meses a anos. 2. Degradação proteica. Há dois sistemas enzimáticos principais, responsáveis pela degradação de proteínas danificadas ou desnecessárias: o sistema ubiquitina-proteassomo, dependente de energia (ATP), no citosol, e as enzimas degradativas dos lisossomos, não dependentes de ATP. Os proteassomos degradam principal- mente proteínas endógenas, ou seja, proteínas sintetizadas dentro da própria célula. As enzimas lisossomais (hidrolases ácidas, degradam principalmente proteínas extracelulares, como proteínas plasmáticas, captadas pela célula por endocitose, e proteínas de superfície da membrana celular, utilizadas na endocitose mediada por receptor. a. Via proteolítica ubiquitina-proteassomo. As proteínas destinadas à degradação pelo sistema ubiquitina-proteassomo são inicialmente ligadas covalentemente à ubiquitina, uma pequena proteína globular não enzimática. A ubiquitinação do substrato-alvo ocorre por meio da ligação da α-carboxila da glicina C-terminal da ubiquitina a um grupo "e"-amino de uma lisina da proteína que serve de substrato, em um processo de três etapas catalisado enzimaticamente e dependente de ATP. A adição consecutiva de porções ubiquitina gera uma cadeia de poliubiquitina. As proteínas marcadas com ubiquitina são então reconhecidas por um grande complexo proteolítico macromolecular, com formato de barril, denominado proteassomo, que funciona como “lata de lixo” . O proteassomo desenrola, desubiquitina e corta a proteína-alvo em fragmentos, posteriormente degradados em aminoácidos, que entram no conjunto dos aminoácidos. (Nota: as ubiquitinas são recicladas.) Deve-se observar que a degradação seletiva de proteínas pelo complexo ubiquitina-proteassomo, ao contrário da simples hidrólise por enzimas proteolíticas, requer energia na forma de ATP. b. Sinais químicos para a degradação proteica. Uma vez que as proteínas apresentam meias-vidas distintas, é evidente que a degradação proteica não pode ser aleatória, mas deve ser influenciada por algum aspecto estrutural da proteína. Por exemplo, algumas proteínas alteradas quimicamente por oxidação ou marcadas com ubiquitina são degradadas preferencialmente. A meia-vida de uma proteína é influenciada pela natureza de seu resíduo N-terminal. Por exemplo, pro- teínas que apresentam serina como o aminoácido N-terminal têm maior duração, com meia-vida de mais de 20 horas. Em contraste, proteínas com aspartato como o aminoácido N-terminal apresentam meia-vida de apenas três minutos. Além disso, proteínas ricas em sequências contendo prolina, glutamato, serina e treonina (denominadas sequências PEST, devido às designações de uma letra para esses aminoácidos) são degradadas rapidamente e, portanto, apresentam meias-vidas intracelulares curtas.
DIGESTÃO E ABSORÇÃO DE PROTEÍNAS E AMINOÁCIDOS
A oferta nitrogenada da dieta se faz predominantemente a partir de proteína animal e vegetal íntegra e sua digestão se inicia no estômago mediante a ação de proteases. A digestão das proteínas possui três fases:
A. . Lúmen intestinal
B.. Borda em escova
C. .Citoplasmática
Fase do lúmen intestinal — A pepsina é a principal enzima proteolítica gástrica; secretada na forma de pepsinogênio, é ativada na presença do ácido clorídrico, necessitando de pH entre 2,0 e 5,0. A enzima péptica atua sobre os vários tipos de proteína da dieta, em particular sobre o colágeno, o que facilita a digestão e a absorção das proteínas derivadas das carnes. Nos lactentes jovens a produção ácida e de pepsina é reduzida, porém não há prejuízo da digestão protéica. Em condições normais, o tempo de esvaziamento gástrico e a hipermotilidade intestinal parecem ser fatores limitantes para a absorção protéica e não o grau de hidrólise3.
O produto da digestão gástrica (peptonas, proteoses, polipeptídios e alguns aminoácidos) chega ao duodeno, onde estimula a liberação de colecistoquinina, que, por sua vez, estimula a secreção de enzimas pancreáticas. O pâncreas secreta as proenzimas que serão ativadas após contato com a enteroquinase da borda em escova por meio do estímulo do tripsinogênio e dos sais biliares. A ação hidrolítica das endopeptidases ancreáticas (a partir do tripsinogênio pela ação da enteroquinase),tripsina, quimiotripsina, elastase e carboxipolipeptidase A e B (exopeptidases) produzirá
polipeptídios e aminoácidos.
Fase da borda em escova — No intestino ocorre a hidrólise de tetrapeptídios por amino-polipeptidases e dipeptidases do epitélio celular (borda em escova) jejunal e ileal proximal. Algumas dessas enzimas possuem atividade reduzida no período neonatal, o que não parece comprometer a digestão protéica.
Fase citoplasmática — Alguns tripeptídios e dipeptídios são hidrolisados pelas enzimas tripeptidases e dipeptidases intracelulares do epitélio intestinal. Uma porção desses peptídios (incluindo os hormônios hipotalâmicos liberadores da tireotrofina e do hormônio luteinizante) atinge a circulação portal sem sofrer a ação hidrolítica.
OBS.:
Como as proteínas não são absorvidas na região colônica, aquelas que atingem esta porção intestinal são eliminadas do organismo ou sofrem ação bacteriana e formam amônia, que é então absorvida e entra no metabolismo proteico.
A absorção de proteínas se dá nas formas de dipeptídios, tripeptídios e aminoácidos. A absorção intestinal é rápida e ocorre principalmente no duodeno e no jejuno. O transporte de peptídios é eletrogênico e ocorre por meio de gradientes de pH basolateral apical mantido pela troca de Na+/H+ na membrana apical e Na+/K+ na basolateral. Existem quatro sistemas básicos de transporte de aminoácidos: transportadores específicos de aminoácidos neutros, ácidos, básicos e seletivos para prolina e hidroxiprolina. O transporte tem maior afinidade pelos aminoácidos L-isômeros do que para os D-isômeros e pode ocorrer por difusão passiva, facilitada ou ativa, dependente de sódio.
Após a absorção, os aminoácidos entram no pool de aminoácidos do organismo (plasma e reserva tissular) e são utilizados para a síntese de outros aminoácidos ou proteínas na produção de energia, ou sofrem degradação e reutilização. No leito esplâncnico, a mucosa intestinal e o fígado, e, perifericamente, na musculatura, a taxa de metabolismo de aminoácidos é elevada. Os aminoácidos de metabolismo principal no intestino são a glutamina e o glutamato provenientes da dieta. Ocorre oxidação incompleta, com liberação de CO2, N2 e alanina ou lactato. A glutamina sistêmica e o
glutamato enteral parecem atuar como precursores da biossíntese das células intestinais, mantendo a síntese de glutation, arginina e prolina.
O fígado modifica as proporções de aminoácidos do sangue portal a serem distribuídas para o restante do organismo. A maior parte dos aminoácidos extraídos do sangue portal pelo fígado é catabolizada; cerca de 25% são devolvidos à circulação e uma pequena parte é direcionada para a síntese protéica. Caberá ao fígado a síntese de uréia a partir da amônia (hepatócitos periportais) e de glutamina (setor perivenoso) se a síntese de uréia for insuficiente para a eliminação da amônia hepática. O fígado é responsável, ainda, pela síntese das proteínas plasmáticas (albumina, globulina, fibrinogênio) e dos reagentes de fase aguda em períodos de estresse. Ocorre na musculatura esquelética o metabolismo dos aminoácidos de cadeia
ramificada, com liberação do nitrogênio sob a forma de alanina e glutamina. Os esqueletos de carbono podem, ainda, ser totalmente oxidados
a CO2 ou entrar no ciclo do ácido cítrico. Os rins, por sua vez, convertem glicina em serina ou glutamina em glutamato com produção de íons amônio e bicarbonato, responsáveis pelo equilíbrio acidobásico. É também nos rins que ocorre a desaminação dos D-aminoácidos.
METABOLISMO PROTÉICO
SÍNTESE PROTÉICA
Cada tecido possui um limite de armazenamento de proteínas. Além deste limite, o excesso de aminoácidos circulantes é degradado para a produção de energia ou sofre conversão em glicogênio (gliconeogênese) ou lipídios (cetogênese) para armazenamento. Esses processos metabólicos proteicos ocorrem por meio de reações de transaminação catalisadas pelas enzimas aminotransferases ou transaminases, derivadas da piridoxina, e desaminação oxidativa.
A transaminação é responsável pela transformação de um aminoácido em outro não-essencial mediante a transferência de grupos alfa-amino (NH3+) de um aminoácido para um precursor alfacetoácido (oxalacetato, α-cetoglutarato, glutamato ou piruvato), enquanto o oxigênio é transferido para o doador do radical amino.
Nas reações de desaminação catalisadas por aminoácido-oxidases, grupos amino são removidos de um aminoácido com liberação de um esqueleto carbônico e amônia. Um exemplo dessa reação é o glutamato, que sofre a ação da glutamato desidrogenase, dando origem à α-cetoglutarato e à amônia, que entra no ciclo da ureia.
O catabolismo hepático dos aminoácidos, por meio dos produtos intermediários das vias glicolíticas e do ciclo do ácido cítrico, atua como fonte de energia para a produção de glicose. A formação de ureia ocorre no fígado a partir da conversão de duas moléculas de amônia sanguínea e uma de dióxido de carbono em combinação, dando origem a substâncias intermediárias como citrulina, arginina e ornitina. Esta última é novamente utilizada neste ciclo e a uréia se difunde pelos líquidos corporais até a eliminação renal.
DEGRADAÇÃO PROTÉICA
A degradação proteica celular ocorre de forma contínua, prevenindo o acúmulo de proteínas anormais ou lesivas e fornecendo ao organismo aminoácidos livres nas fases de privação alimentar. Existem três sistemas proteolíticos celulares importantes:
Sistema autofágico lisossômico — Formado por catepsinas, é importante para a degradação de proteínas que penetram nas células por endocitose e na proteólise celular. Há a formação de estruturas vacuolares capazes de englobar e degradar organelas complexas. A regulação deste sistema parece estar relacionada com a ação da insulina e a interação dos aminoácidos alanina e leucina.

Sistema calpaína-calpastatina — Principal via de degradação das proteínas, é ativado pelo cálcio. Formado por um complexo de cisteína protease e
uma subunidade reguladora que se une ao cálcio. Está relacionado à proteólise incompleta das membranas celulares e a estruturas microfilamentosas, com ação no nível muscular.
Sistema ubiquitina-proteasoma — É formado por um sistema de reconhecimento que marca os substratos protéicos a degradar, a ubiquitina, e um complexo multienzimático proteolítico, a proteasoma. Presente nos diversos tecidos, é dependente de ATP e catalisa a proteólise de forma completa. Esta via possui ampla atuação protéica e parece atuar mais especificamente nas situações em que há atrofia por desnervação.
(2)
NOVA SÍNTESE:


REFERÊNCIAS:
(1) Vet - Bioquímica Animal - UNESP - http://www2.fct.unesp.br/docentes/edfis/ismael/nutricao/Amino%E1cidos%20e%20prote%EDnas%20pgs%209%20a%2013%20e%2017.pdf
(2)Simone Iglesias, USP, 2005, Metabolismo Proteico - Uso de Aminoácidos e Proteinas Especiais (Arginina, Glutamina, Aminoácidos de Cadeia Ramificada, Albumina - https://www.researchgate.net/publication/272020545_Metabolismo_Proteico_-_Uso_de_Aminoacidos_e_Proteinas_Especiais_Arginina_Glutamina_Aminoacidos_de_Cadeia_Ramificada_Albumina
2. COMO A MÍDIA PODE GERAR ESTERIÓTIPOS DE BELEZA? A
A mídia e a indústria da “corpolatria” produzem um discurso que nos diz o tempo todo que beleza, saúde, potência, sedução e sucesso são indissociáveis e que não poderemos jamais viver sem esses elementos. Cuidar do corpo em si, nos afirmam eles, é indispensável ao bem-estar e à felicidade. Ser jovem, saber dançar os ritmos da moda, vestir-se bem, frequentar academias são alguns ditames que estão sendo incutidos no tecido social. A criação constante de necessidades pelo sistema midiático e pelo mercado vem fomentando o narcisismo e o hedonismo.
Consideramos também que através do consumo e do uso do corpo os indivíduos constroem suas identidades e estabelecem relações sociais. O corpo, aqui, é entendido como um veículo (instrumento) ou um recurso (um capital) de poder e auto-expressão. É uma mercadoria-signo, sendo assim, um meio através do qual os indivíduos criam vínculos e estabelecem distinções sociais.
O fenômeno do culto ao corpo na contemporaneidade emerge, no Brasil, a partir da década de 1920, com a chegada do cinema, crucial na formulação de um ideal físico. No fim dessa mesma década, segundo Featherstone (1993), sob o impacto das indústrias de cosmético, da moda, da publicidade e de Hollywood, mulheres aderem ao uso de maquiagens e passam a valorizar o corpo magro. Nesse mesmo período, ocorre o advento da dieta como forma de controle pessoal do peso. Emerge daí a necessidade de os indivíduos tomarem para si a responsabilidade de desenhar o seu próprio corpo, como forma de definir a sua identidade e o projeto do self.
Consumidores desenvolvem um mosaico de significados através da construção e desconstrução da propaganda e outras formas de mídia. Raramente uma pessoa não atraente é apresentada como garoto-propaganda nos filmes publicitários, justamente por acreditar-se que a atratividade física aumenta a eficácia do efeito da propaganda nos telespectadores e, com isso, incrementará a venda do produto anunciado. A atratividade física tornou-se recurso de persuasão e tentativa de melhoria da atitude do consumidor para com o produto, com a marca e incremento na sua intenção de compra. A atratividade física é o elemento visível que as pessoas dispõem e utilizam para formar opiniões e fazer julgamentos acerca da personalidade, status e posição social de outras pessoas.
Consumidores percebem que a mídia apresenta um mundo estilizado e idealizado. Programas de televisão, filmes, anúncios em revistas, fotos e imagens em calendários, etc., são todos bem iluminados, harmônicos, transmitindo e reforçando a imagem idealizada de perfeição. Imagens de homens musculosos e bem-sucedidos e de mulheres bonitas, atraentes e sensuais são veiculadas ostensivamente em uma tentativa de transferir sentimentos e características do(a) modelo para o produto, como uma “contaminação” com o sagrado. Corpos são colocados em cena em função das fantasias humanas tentando-se, assim, evocar (e satisfazer?) seus desejos sexuais. O corpo nada mais é, nesse contexto, que um objeto socialmente estereotipado, idealizado.
O culto ao corpo extrapola as práticas e relações do microambiente das interações pessoais. Assume também proporções maiores, quando atinge dimensões macro, em atividades e eventos pertencentes à sociedade como um todo. Por exemplo, o Brasil é reconhecido por suas belezas naturais e peculiaridades culturais, o que o posiciona internacionalmente como um país exótico, o que atrai visitantes de todas as partes do mundo. O exotismo relaciona-se, inseparavelmente, à apreciação da beleza. Contudo, o lado exótico também é fortemente associado a um viés erótico. Paisagens paradisíacas associam-se à sexualidade no imaginário coletivo; o clima quente dos trópicos aliado à abundância litorânea do Brasil, reforçam o mito do “país sensual”. As imagens produzidas na mente dos indivíduos e grupos estimulam incessantemente esse culto ao corpo, introduzindo-se (e reforçando-se) na cultura local.
NOVA SÍNTESE:

REFERÊNCIAS:
IV ENECULT - Encontro de Estudos Multidisciplinares em Cultura 28 a 30 de maio de 2008 Faculdade de Comunicação/UFBa, Salvador-Bahia-Brasil. A INFLUÊNCIA DA MÍDIA E DA INDÚSTRIA DA BELEZA NA CULTURA DE CORPOLATRIA E NA MORAL DA APARÊNCIA NA SOCIEDADE CONTEMPORÂNEA Glauco da Costa Knopp - http://www.cult.ufba.br/enecult2008/14415.pdf
3. RELACIONE UMA DIETA HIPERPROTEICA COM A FALHA HEPÁTICA E RENAL (como a dieta hiperproteica pode levar a falha hepática e renal) C
O aparelho excretor tem a função de eliminar todos os detritos do organismo, bem como as substâncias em excesso, usando como via principal os rins. A ingestão proteica acima das necessidades orgânicas leva ao aumento das reações catabólicas de seus aminoácidos, desencadeando a produção de subprodutos como ureia (H2NCONH2), trifosfato de adenosina (ATP), gás carbônico (CO2), glicose (C6H12O6); acetil coenzima A e corpos cetônicos. Alguns destes subprodutos podem resultar em efeitos adversos ao organismo .
A alta ingestão protéica resulta em sobrecarga renal devido ao aumento da filtração glomerular.
(1)
Riscos da dieta hiperprotéica
A longo prazo, as possíveis consequências de uma elevada ingestão de proteínas manifestam-se, geralmente, a nível cardiovascular e renal
Sugere-se que o aumento do risco de doenças cardiovasculares aconteça devido ao consumo excessivo de proteínas animais, que estão associadas ao maior aporte de gorduras (gordura saturada e colesterol). No entanto, em estudos recentes, observou-se que o aumento do consumo de proteínas associado a um declínio no consumo de hidratos de carbono levou à diminuição dos níveis séricos de LDL (mau colesterol) e aumento do bom colesterol (HDL), havendo também uma diminuição importante dos triglicerídeos.
Em relação à sobrecarga renal, a ingestão proteica, em contraste com a ingestão de gorduras ou de hidratos de carbono, influencia a hemodinâmica renal, estimando-se que o consumo excessivo de proteína resulte em sobrecarga, devido ao aumento da taxa de filtração glomerular (TFG) (filtração dos rins). Este tipo de dietas também parece aumentar o volume renal e o peso do rim. No entanto, o efeito hemodinâmico a longo prazo no rim saudável não é bem compreendido. Também se sabe que um elevado consumo de proteínas predispõe à formação de cálculos renais (pedras nos rins).
A carga ácida é também um importante factor de risco para a DRC. A metabolização das proteínas, dos legumes e dos cereais aumenta os níveis de aniões e ácidos orgânicos no plasma, o que se traduz numa redução do pH do organismo. Já os vegetais e as frutas têm essência alcalina. Um obstáculo no equilíbrio ácido-base leva a problemas que podem culminar na morte se o corpo humano não possuir os mecanismos fisiológicos que asseguram a manutenção de um pH constante. Em resposta ao aumento da acidez, e de forma a que o organismo volta ao seu equilíbrio, são libertados compostos básicos como, por exemplo, catiões, especialmente o cálcio dos ossos, o que pode conduzir à perda de densidade óssea (osteoporose).
Outro risco potencial de uma dieta hiperproteica é o ácido úrico elevado. No entanto, um estudo recente não encontrou qualquer aumento nos níveis de ácido úrico em pessoas submetidas uma dieta hiperproteica. Embora não exista qualquer evidência de uma relação causa-efeito, é recomendável que o consumo de alimentos ricos em purinas seja controlado.
Convém salientar que o impacto renal de uma adesão a uma dieta hiperproteica por um curto período de tempo é, provavelmente, diferente do impacto causado por um regime alimentar prolongado. Desta forma, apesar de não haver uma contra-indicação renal clara relativa às dietas hiperproteicas na pessoa com função renal normal, os riscos teóricos existem e devem ser analisados. Quem estiver disposto a aderir a este regime alimentar deve ser bem acompanhado por profissionais competentes.
Por outro lado, os riscos potenciais de uma dieta hiperproteica na pessoa com DRC(doença renal crônica), baseiam-se na progressão acelerada da doença, no aumento da proteinúria, em distúrbios electrolíticos e de volume graves, na tendência aumentada para a formação de cálculos renais e no agravamento de sintomas urémico.
(2)
NOVA SÍNTESE:

REFERÊNCIAS:
(1) Aline Paiva, Revista Brasileira de Nutrição, Efeitos da alta ingestão diária de proteínas no metabolismo - 2007 - http://www.colegiosacramentinas.com.br/professor/wp-content/uploads/2015/03/Artigo-61.pdf
(2) ATKINS R, - Dr Atkins’ New Diet Revolution. New York, 1999.
OLIVEIRA, H.P. - Efeitos de uma dieta hiperproteica a nível renal. [Dissertação de Mestrado Integrado em Medicina]. Covilhã: Faculdade de Ciências da Saúde Universidade da Beira Interior, 2008, 25p
Spnefro - Sociedade Portuguesa de Nefrologia, (2015). Spnefro - Sociedade Portuguesa de Nefrologia. [online] Available at: http://www.spnefro.pt
4. CONCEITUE ICTERÍCIA E RELACIONE ESTA COM O EXCESSO DE TESTOSTERONA PELO USO DE ANABOLIZANTES D, G
Icterícia
A icterícia refere-se à cor amarelada da pele, do leito ungueal e da esclera (o branco dos olhos) causada pela deposição de bilirrubina nesses tecidos, secundária a um aumento dos níveis de bilirrubina no sangue. Embora não seja uma doença, a icterícia é normalmente um sintoma da existência de distúrbio subjacente.
1. Tipos de icterícia.
A icterícia pode ser classificada em três formas principais, descritas a seguir. No entanto, na prática clínica, a icterícia é frequentemente mais complexa do que o indicado nesta classificação simples. Por exemplo, o acúmulo de bilirrubina pode ser resultado de defeitos em mais de um passo de seu metabolismo.
Icterícia hemolítica.
O fígado possui a capacidade de conjugar e excretar, por dia, mais de 3.000 mg de bilirrubina, ao passo que a produção normal desse composto é de apenas 300 mg/dia. Essa grande capacidade permite que o fígado responda ao aumento na degradação do heme com o aumento cor- respondente na conjugação e na secreção de diglicuronato de bilirrubina. No entanto, a lise maciça de eritrócitos (p. ex., em pacientes com anemia falciforme, deficiência de piruvato-cinase ou de glicose-6-fosfato-desidrogenase) pode levar a uma produção de bilirrubina mais rápida do que a capacidade hepática de conjugá-la. Os níveis de bilirrubina não conjugada no sangue tornam-se aumentados, causando a icterícia. (Nota: mais bilirrubina conjugada é excretada na bile, a quantidade de urobilinogênio da circulação entero-hepática aumenta, e o urobilinogênio urinário aumenta.)
Icterícia hepatocelular.
Lesão nos hepatócitos (p. ex., em pacientes com cirrose ou hepatite) pode causar aumento nos níveis sanguíneos de bilirrubina não conjugada, devido a uma redução na conjugação. O urobilinogênio aumenta na urina, pois a lesão hepática diminui a circulação entero-hepática desse composto, permitindo que maior quantidade dele chegue ao sangue, de onde é filtrado para a urina. A urina então torna-se escura, e as fezes apresentam cor de argila clara. Os níveis plasmáticos de AST (GOT) e ALT apresentam-se elevados. (Nota: Se a bilirrubina conjugada não é secretada eficientemente para a bile [colestase intra-hepática], ela difunde [“vaza”] para o sangue, causando uma hiperbilirrubinemia conjugada.)
Icterícia obstrutiva.
Nesse caso, a icterícia não é causada por superprodução de bilirrubina ou por redução na conjugação, mas resulta da obstrução do ducto biliar (colestase extra-hepática). Por exemplo, a presença de tumor hepático ou de cálculos biliares pode causar bloqueio nos ductos biliares, impedindo a passagem da bilirrubina para o intestino. Os pacientes com icterícia obstrutiva apresentam dor gastrintestinal e náusea e produzem fezes claras, cor de argila, e urina que escurece ao ser deixada em repouso. O fígado “regurgita” a bilirrubina conjugada para o sangue (hiperbilirrubinemia). Esse composto é por fim excretado na urina. Há ausência de urobilinogênio urinário. (Nota: a obstrução prolongada do ducto biliar pode levar à lesão hepática, com subsequente aumento na bilirrubina não conjugada.)
(1)
O extenso metabolismo dos EAA orais leva a hepatotoxicidade importante. A icterícia deve-se a estase e acúmulo de bile em porções centrais dos lóbulos hepáticos, sem obstrução dos ductos maiores e, se ocorre, é geralmente após 2 a 5 meses de uso. Os testes de função hepática como a bilirrubina e fosfatase alcalina mostram-se elevados. A severidade das alterações é dose dependente. As anormalidades na função hepática são geralmente reversíveis com a descontinuação da droga. A colestase está quase sempre associada ao uso de derivados 17-a-alquilados, mas o mecanismo de ação não está claro. A colestase induzida por esteróides é, usualmente, rapidamente reversível após a parada do uso, raramente perdurando por vários meses
(2)
NOVA SÍNTESE:

REFERÊNCIAS:
(1) Livro: Bioquímica Ilustrada - Harvey e Ferrier
(2) Lise .M.L.T - Rev. Assoc. Med. Bras. vol.45 n.4 São Paulo Sept./Dec. 1999 - http://dx.doi.org/10.1590/S0104-42301999000400014
5. QUAIS AS EXPLICAÇÕES DO EXCESSO DO EXERCICIO FÍSICO NO METABOLISMO PROTEICO B
Tendo em vista que o exercício físico é uma condição na qual observa-se uma rápida mobilização e redistribuição energética para o desempenho da atividade muscular, inúmeras alterações nas secreções hormonais e no metabolismo tornam-se necessárias para a manutenção da homeostasia orgânica. A redução das concentrações séricas de glicose e insulina na condição de repouso poderia indicar uma adaptação metabólica com aumento da captação deste substrato pelos tecidos periféricos. Contudo, no presente estudo não foram detectadas diferenças nas concentrações de glicose sérica dos animais sedentários e treinados. Quando submetidos à sessão aguda de exercício, os animais de ambos os grupos apresentaram uma elevação da glicemia em relação aos valores de repouso. Este aumento glicêmico possivelmente deve-se à contribuição do metabolismo de carboidratos a partir da glicólise anaeróbia, onde a utilização de glicogênio muscular pode ocorrer predominante nos primeiros minutos de atividade. Além disso, a possibilidade da gliconeogênese na contribuição do aumento glicêmico não deve ser descartada.
A secreção insulínica também pode sofrer a ação da realização crônica do exercício físico, apresentando-se reduzida tanto na condição de repouso quanto na de pós-exercício (Peres et al., 1998). Entretanto, observamos que, na condição de repouso, as concentrações séricas de insulina não diferiram entre os animais dos grupos S e T. Após a realização da sessão única de exercício, somente os animais do grupo sedentário apresentaram redução dos níveis de insulina no soro. Rogatto e Luciano (2000a) observaram uma redução média de 50% nas concentrações de insulina após a realização do esforço agudo em ambos os grupos sedentário e treinado. A redução da insulinemia após a realização do exercício agudo pode dever-se a um “mecanismo de proteção” do organismo no sentido de favorecer a manutenção da homeostasia glicêmica, já que a captação de glicose pode apresentar-se aumentada após a realização do esforço e, assim, resultar em hipoglicemia. Esta maior captação glicídica certamente ocorreu no pós-exercício tendo em vista a observação de favorecimentos dos estoques de glicogênio muscular, mesmo com concentrações de insulina semelhantes, como observado em alguns estudos que se utilizaram do mesmo modelo de treinamento físico. Além disso, o aumento da sensibilidade periférica à insulina pós-exercício, o aumento do número de transportadores de glicose “GLUT 4” translocados no músculo, e a estimulação mecânica decorrente do processo de contração muscular repetida podem favorecer o “aproveitamento” da glicose circulante na síntese glicogênica. Alguns estudos têm reportado a influência da atividade física regular sobre o estoque de substratos energéticos em diferentes tecidos. Tais adaptações contribuem com a capacidade do organismo em desenvolver trabalho muscular, favorecendo assim a performance. A ativação constante da musculatura, durante a realização da contração muscular pode contribuir com o aumento da estimulação necessária para ocorrer síntese proteica .
Alguns autores vêm usando esta medida como indicativo da presença de hiperplasia e/ou hipertrofia muscular, sendo que um aumento da concentração de DNA indicaria aumento do número de fibras musculares, e um incremento da razão proteína/ DNA apontaria para aumentos da área de secção transversa da fibra muscular. Alguns estudos que se utilizaram de exercícios resistidos para avaliação da síntese proteica encontraram elevações na razão de síntese deste substrato. No presente estudo não encontramos diferenças significativas nos teores de proteínas totais e DNA musculares, e na razão proteína/DNA do músculo gastrocnêmio. A ocorrência de tais resultados pode estar relacionada à composição corporal, DNA total ou ainda insuficiência do exercício físico utilizado sobre a ativação de mecanismos relacionados à síntese proteica.
O desenvolvimento da massa muscular e, consequentemente, do metabolismo proteico dependem, além da insulina e da atividade contrátil, de outros fatores como, por exemplo, hormônio do crescimento (GH) . Os níveis de GH podem ser influenciados pela atividade física, com tendência a elevação em exercícios agudos intensos. No presente trabalho não avaliamos os teores desse hormônio, contudo, considerando que os níveis insulinêmicos mantiveram-se constantes
Tendo em vista que o exercício físico é uma condição na qual observa-se uma rápida mobilização e redistribuição energética para o desempenho da atividade muscular, inúmeras alterações nas secreções hormonais e no metabolismo tornam-se necessárias para a manutenção da homeostasia orgânica. A redução das concentrações séricas de glicose e insulina na condição de repouso poderia indicar uma adaptação metabólica com aumento da captação deste substrato pelos tecidos periféricos. Contudo, no presente estudo não foram detectadas diferenças nas concentrações de glicose sérica dos animais sedentários e treinados. Quando submetidos à sessão aguda de exercício, os animais de ambos os grupos apresentaram uma elevação da glicemia em relação aos valores de repouso. Este aumento glicêmico possivelmente deve-se à contribuição do metabolismo de carboidratos a partir da glicólise anaeróbia, onde a utilização de glicogênio muscular pode ocorrer predominante nos primeiros minutos de atividade. Além disso, a possibilidade da gliconeogênese na contribuição do aumento glicêmico não deve ser descartada.
(1)
NOVA SÍNTESE:

REFERÊNCIAS:
(1) Influência do Treinamento Físico Intenso Sobre o Metabolismo de Proteínas, 2001, Gustavo Puggina Rogatto e Eliete Luciano - Universidade Estadual Paulista - http://www.rc.unesp.br/ib/efisica/motriz/07n2/aRogatto.pdf
6. EXPLIQUE A AÇÃO DO EXCESSO DE TESTOSTERONA NO CORPO FEMININO E, F





Comentários